pH의 정의
수용액은 산성, 알칼리성, 중성 정도로 분류될 수 있다. 화학에서 pH라는 단위로 측정될 수 있다. 칼스버그 재단(Carlsberg Foundation)에 따르면 pH는 수소이온 농도(power of hydrogen)를 뜻한다. 이 수치는 로그값이며, 최소 1에서 최대 14까지의 값을 가진다. pH를 수식으로 나타내면 pH = –log(H+)와 같다. 따라서 수소이온 농도가 리터당 1.0 × 10–2몰이면, pH = –log(1.0 × 10–2)가 되어서 2가 된다. 증류수 같은 수용액은 pH가 7이며, 이는 중성에 해당된다. pH가 7보다 낮은 용액은 산성, 7보다 높은 용액은 알칼리성을 띤다. 로그값은 용액의 산성 정도를 특정 기준에 비교해 알려준다. 예를들면, pH가 5인 용액은 pH가 6인 용액보다 산성도가 10배 높으며, pH가 8인 용액보다는 1,000배 높다.
pH 지시약
수용액의 pH를 측정하는 방법에는 여러가지가 있다. 측정을 위해 리트머스 종이나 유리 탐침을 사용할 수 있다.
리트머스 지시약
리트머스 지시약은 보통 pH를 표시하는 역할을 하는 지의류에서 추출한 염료로 만들어진다. 지시약이 용액에 닿으면 화학 반응으로
인해 특정 pH 농도를 나타내는 색으로 변한다. 리트머스 지시약은 기본적으로 두 가지 방식으로 사용할 수 있다. 첫 번째는 이미
pH를 알고 있는 기준 색과 완충액을 사용해 테스트 용액에 첨가한 리트머스 지시약의 색을 서로 비교하는 것이다. 또 다른
방법은 지시약을 침투시킨 pH 시험지를 준비해서 이를 테스트 용액에 담근 뒤 나타난 색을 기준 색과 비교하는 것이다. 두 가지
모두 쉽게 해 볼 수 있는 방법이지만, 테스트 용액의 온도나 외부 물질에 따라 오차가 발생하기 쉽다.
pH 유리 탐침
pH를 확인하는 데 가장 흔히 사용되는 것은 pH 탐침이다. 탐침은 전극과 기준 전극을 측정하는 유리로 이루어져 있다. 대표적으로 사용되는 유리 탐침은 염화수소(HCl) 용액을 감싸고 있는 얇은 유리막으로 이루어져 있다. 막 안에는 염화은(AgCl)으로 덮인 은 전선이 들어 있는데, 이 전선은 HCl 용액과 연결되는 기준 전극 역할을 한다. 유리막 밖의 수소이온은 유리막을 통과해 확산된 뒤 대부분의 유리에 보통 포함되어 있는 나트륨이온(Na+)을 내보내고, 그 자리를 차지한다. 이러한 양이온은 감지가 힘들며, 대부분이 막을 기준으로 농도가 낮은 쪽의 유리 표면에 흡착된다. Na+로부터 전하가 과하게 생기면 센서의 출력부에 전위(전압)을 발생시킨다.
탐침은 배터리와 원리가 비슷하다. 탐침을 용액에 넣으면 측정용 전극에서 용액의 수소이온 활동도(hydrogen activity)에 따라 전압이 생성되는데, 이 전압과 기준 전극의 전위와의 비교가 이루어진다. 용액의 산성도가 높아지면(pH 값이 낮아지면) 유리 전극의 전위가 기준 전극보다 양의 방향으로 증가(+mV)하고, 용액의 염기도가 증가하면(pH 값이 높아지면) 유리 전극의 전위가 기준 전극보다 음의 방향으로 증가한다(−mV). 이들 두 전극 사이의 전위차를 측정 전위라고 한다. 일반적인 pH 탐침은 이상적인 조건에서 25°C일 때 59.154mV/pH를 발생시킨다. 이는 보통 아래의 네른스트식(Nernst Equation)으로 나타낼 수 있다.
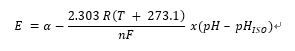
E = 산성도를 모르는 수소이온의 전압
a = ±30mV, 영점 오차
T = 25°C, 주위 온도
n = 25°C일 때 1, 원자가(이온전하 수)
F = 96485C/mol, 패러데이 상수
R = 8.314J/mol?K, 아보가드로 수
pH = 모르는 용액의 수소이온 농도
pHISO = 7, 기준 수소이온 농도
이 식은 생성된 전압의 크기가 용액의 산성도나 염기도에 좌우되며, 여기에 해당되는 것 중 하나가 수소이온의 농도다. 용액의 온도가 변하면 수소이온의 농도도 변한다. 용액의 온도가 올라가면 수소이온이 더 빨리 움직이며, 그 결과 두 전극 사이의 위상 차가 커진다. 또한, 용액의 온도가 내려가면 수소이온 농도가 낮아져서 위상 차가 감소한다. 이상적인 조건에서 전극은 pH 값이 7인 완충액에 담갔을 때 0V의 전위를 생산하도록 설계된다.
다음의 표에서는 대표적인 pH 탐침의 사양을 확인할 수 있다.
표 1. pH 유리 탐침의 기본적인 사양
| 측정 범위 | pH 0~pH 14 |
| 0V에서 pH | pH 7.00 ±0.25 |
| 정확도 | 20°C~25°C의 온도 범위에서 pH 0.05 |
| 해상도 | pH 0.010.1mV |
| 작동 온도 | 최대 80°C |
| 반응 시간 | 최종 값의 95%에 대해 1초 이하 |
pH 탐침은 이 연구에서 중요한 역할을 하는데, 데이터 신뢰도가 센서의 정확도와 안정성에 좌우되기 때문이다. pH 탐침을 선택할 때 고려해야 할 중요한 두 가지 요인은 완충액에서 온도 변화 후의 안정화 시간과 pH 변화 후의 안정화 시간이다. 그 예로 들 수 있는 것이 젠웨이(Jenway)의 애플리케이션 노트인 ‘젠웨이 성능 pH 전극의 평가’1에서 얻은 데이터다. 데이터시트에서는 주어진 테스트 환경에서 온도 변화 후의 안정화를 테스트하여 젠웨이 탐침의 성능을 보여준다. 테스트에서는 20°C, pH 7인 용액과 60°C, pH 4인 완충액을 비교했으며, 각 전극은 200rpm의 속도로 젓고 있는 pH 7의 완충액에서 안정화되도록 두었다. 안정화된 전극은 탈염수로 씻어낸 뒤 pH 4의 완충액 부분 표본으로 옮겨 4분 간 두었다. 그런 다음 전극을 다시 탈염수로 씻어서 pH 7 완충액으로 다시 옮겼다. 그 뒤 10초간 안정된 상태로 유지될 때까지 걸리는 시간을 측정헸다. 테스트는 각 탐침마다 세 번씩 반복했다.
표 2. 완충액 온도를 바꾸었을 때의 안정화 시간
| 범용 pH 탐침 | 젠웨이(35xx 시리즈 pH 탐침) | |
| 1 | 77 | 36 |
| 2 | 77 | 33 |
| 3 | 49 | 34 |
| 평균 | 67.6667 | 34.3333 |
표 3. 완충액 pH를 바꾸었을 때의 안정화 시간
| 범용 pH 탐침 | 젠웨이(35xx 시리즈 pH 탐침) | |
| 1 | 29 | 21 |
| 2 | 31 | 26 |
| 3 | 38 | 21 |
| 평균 | 32.6667 | 22.6667 |
젠웨이의 성능은 범용 pH 탐침과 비교했을 때 위에서 말한 조건에서 반응 시간이 50% 더 빨랐다. 이와 같은 기기를 사용하면 높은 샘플 처리율 덕분에 데이터 분석에 필요한 시간을 크게 줄일 수 있다는 장점이 있다.
센서 아날로그 신호 조정 회로
적절한 신호 조정 회로를 만들기 위해서는 센서의 등가 전기 다이어그램을 이해하는 것이 중요하다. 앞에서 설명했듯이, pH 탐침은 최소 1MΩ에서 최대 1GΩ에 이를 수 있는 높은 저항을 생성하는 유리로 이루어져 있으며, 그림 1과 같이 pH 전원과 직렬로 연결되어 있을 때 저항의 역할을 한다.
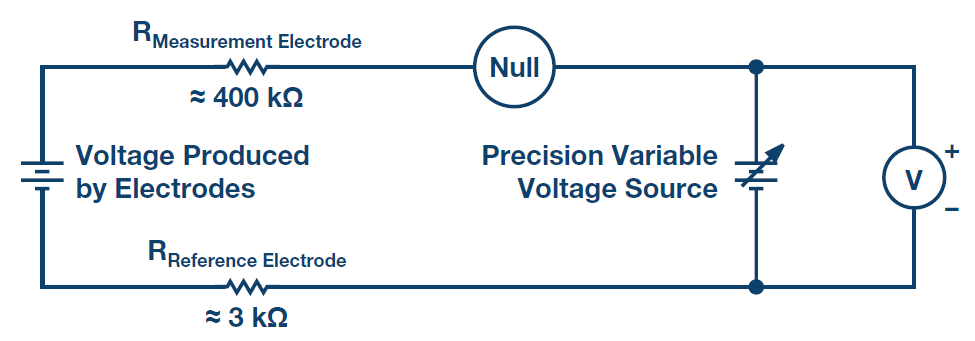
회로(특히 측정 전극의 유리막)에 사용된 각 부품의 높은 저항을 통과하는 회로의 전류는 그 크기가 아무리 작다고 해도 저항에 상대적으로 높은 전압 강하를 발생시켜, 계측기에서 측정되는 전압의 크기를 크게 줄인다. 설상가상으로 측정 전압에 의해 발생한 전압차가 밀리볼트(mV) 수준으로 아주 작다(이상적인 조건일 경우 실온에서 pH 단위당 59.16mV). 이런 작업에 사용되는 계측기는 감도가 아주 뛰어나고 입력 저항이 매우 높아야 한다.
아날로그-디지털 변환
이러한 유형의 애플리케이션의 경우 센서의 반응 시간을 고려하면 데이터 수집을 위한 샘플링율이 문제가 된다. 주어진 센서의 해상도가 0.001V rms이고 ADC 풀스케일 전압 범위가 1V라고 할 때, 효과적인 9.96 비트의 해상도를 얻기 위해 고해상도 ADC를 사용할 필요는 없다. 잡음 없는 해상도는 비트의 단위로 정의된다. 무잡음 해상도 = log2 [풀스케일 입력 전압 범위/센서의 피크간 전압 출력 잡음]. ADC의 샘플링률은 전력 소비와 직결되어 있기 때문에 저전력 애플리케이션에서는 중요한 요인이 될 수 있다. 따라서 센서의 반응 시간을 고려했을 때, 일반적인 ADC 샘플링률은 최소 처리율로 설정될 수 있다. 부품 수를 줄이기 위해서는 ADC가 통합된 마이크로컨트롤러를 사용할 수도 있다.